Подборка онлайн-ресурсов для «прокачки» химии
Содержание:
- Применение органических веществ
- Пример 1
- Советы для подготовки к ЕГЭ по химии
- Составьте план
- Выберите наставника
- Определите ресурсы для подготовки к ЕГЭ
- Изучите спецификацию КИМ по предмету
- Внимательно читайте задания тестовой части
- Изучите критерии оценивания заданий части 2
- Не читайте узкоспециализированную литературу
- Научитесь работать с непрограммируемым калькулятором
- Проверяйте свои знания
- Цепочки (схемы) превращений
- Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
- Какие темы есть в ЕГЭ по химии?
- BuboUnicus
- Химические реакции (ОВР, химическое равновесие, скорость реакции и т.п.)
- Изменения в ЕГЭ по химии 2022
- Какой учебник по химии лучше
- Организационные моменты
- Основные понятия и законы химии
- Теория к заданию 11 из ЕГЭ по химии
- Строение атома и периодический закон
- Ответы:
- SkySmart
Применение органических веществ
Органические вещества – это класс химических соединений, объединяющий все вещества, в состав которых входит углерод.
Алканы
Предельные (насыщенные) углеводороды, атомами водорода: СН4 – метан (основа природного газа), С2Н6 – этан, С3Н8 – пропан, С8Н18 – октан (основа бензина).
- Применяются в качестве топлива: бензин, дизельное, авиационное, пропан-бутановая смесь для бытовых плит.
- Вазелин – незаменим в медицине, парфюмерии, косметологии.
- Входят в состав смазочных масел.
- Хладагент для холодильников.
- Петролейный эфир и циклогексан используются в качестве растворителя.
- Метан незаменимый компонент при производстве шин.
Широко распространено применение данной группы органических соединений в химической промышленности (для производства пластмасс, синтетических волокон и т.д.) и медицине.
Алкены
Соединения служат исходными веществами для получения ряда готовых продуктов:
- растворителей (спиртов, дихлорэтана, эфира);
- полимеров (полиэтилена, поливинилхлорида, полиизобутилена);
Этилен (Н2С=С Н2) используется для получения, тефлона, этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Алкены применяются и для ускорения процесс созревания фруктов.
Алкины (ацетиленовые углеводороды)
Ацетилен – необходим в качестве исходного продукта в органическом синтезе при производстве:
- полимеров (каучука, поливинилхлорида и др.);
- растворителей (1,1,2,2-тетрахлорэтана , 1,1,2-трихлорэтена);
- уксусной кислоты.
Температура пламени вещества достигает 3150°С, что нашло свое применение при резке металла и в сварке.
Спирты
Алкоголи – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу ОН.
Метанол (СН3ОН) –применяется в производстве муравьиной кислоты и формальдегида. Рассматривается как вариант для применения в качестве моторного топлива.
Этанол (С2Н5ОН)- востребован в виде исходного соединения для получения уксусной кислоты, сложных эфиров, карбоновых кислот. Вещество служит основой производства спиртосодержащей продукции и антисептических средств.
Этиленгликоль – компонент необходимый в производстве пластмасс, антифризов, органическом синтезе.
Глицерин – незаменим в разных отраслях промышленности, в том числе текстильной, пищевой, фармакологии.
Фенолы
Основное использование соединений приходится на химическую промышленность, медицину (производство синтетических смол, красителей, антисептиков, взрывчатых веществ и т.д.).
Альдегиды
Метаналь – используется при получении фенолформальдегидных и карбамидных смол, синтезе лекарственных средств, как дезинфицирующее средство.
Этаналь — нашел свое применение в органическом синтезе.
Карбоновые кислоты
Соединения, карбоксильной группы –СООН.
Муравьиная кислота (НСООН) –применяется в фармацевтической и пищевой промышленности. Уксусная кислота (СН3СООН) — востребована для производства искусственных волокон на основе целлюлозы и в пищевой промышленности.
Бензойная кислота (С6Н5СООН) – незаменима в фармацевтике для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов.
Сложные эфиры
Применяются в пищевой и парфюмерной отраслях в качестве отдушек. А также обеспечивают эластичность и пластичность пластмасс и резины.
Также широко распространено в пищевой промышленности, медицине применение глюкозы, аминов, аминокислот. Целлюлоза основной компонент при изготовлении бумаги, пленок, искусственных волокон и т.д.
Много соединений еще не изучено до конца, и возможно, благодаря науке человек сможет заменить натуральные продукты на искусственные, органических соединений природного происхождения применяется все меньше.
Смотри также:
- Понятие о металлургии: общие способы получения металлов
- Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
- Природные источники углеводородов, их переработка
- Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Пример 1
Установите соответствие между видом воздействия на равновесную систему и направлением смещения химического равновесия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
CO32- + H2O ⇄ HCO3— + OH— — Q
| ВОЗДЕЙСТВИЕА) добавление кислотыБ) повышение температурыВ) добавление катализатораГ) разбавление раствора | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ1) в сторону прямой реакции2) в сторону обратной реакции3) практически не смещается |
Решение
А) Добавление кислоты. Видим, что в нашей реакции нет никакой кислоты. Будет ли изменяться равновесие в системе? Конечно, ведь кислота всегда реагирует со щелочью, а за щелочь в реакции отвечают гидроксид-ионы. Равновесие смещается в сторону протекания реакции, то есть вправо.
Б) Повышение температуры смещает равновесие в сторону эндотермической реакции, то есть туда, где теплоты меньше. В сторону прямой реакции.
В) Катализатор не влияет на положение равновесия.
Г) Разбавление раствора – это то же самое, что и добавление воды. А увеличение концентрации реагента смещает равновесие в сторону образования продуктов.
Ответ: 1131.
Если вам все же достанется добавление твердого вещества в качестве воздействия на равновесную систему, помните:
- Твердое нерастворимое вещество не влияет на равновесие.
- Твердое растворимое вещество диссоциирует на ионы. Увеличение концентрации ионов может повлиять на равновесие.
- Твердое растворимое вещество может взаимодействовать с одним из участников реакции. В таком случае равновесие сместится в сторону протекания реакции.
Советы для подготовки к ЕГЭ по химии
Составьте план
Например, каждую неделю в понедельник и среду два часа вы занимаетесь химией. Кроме того, вы можете воспользоваться нашим планером для подготовки. Записывайте в нём главные задачи дня и вопросы учителю, а также что нового вы узнали, какие темы прошли и какие ещё предстоит разобрать, что нужно поискать дополнительно.
Выберите наставника
Найдите человека, который сможет ответить на все возникающие вопросы. Это может быть учитель или знакомый студент, изучающий химию.
Определите ресурсы для подготовки к ЕГЭ
Это и печатные материалы, и электронные образовательные ресурсы. Помните, что ЕГЭ периодически меняют, и не все пособия могут быть актуальными, даже если выпущены в текущем году. Среди популярных ресурсов для подготовки к экзамену по химии:
- Д.Ю. Добротин, «Методические рекомендации обучающимся по организации индивидуальной подготовки к ЕГЭ. Химия», ФИПИ, Москва, 2020 г;
- В.Н. Доронькин и др. «ЕГЭ. Химия. Тематический тренинг. Задания базового и повышенного уровня сложности» Легион, Ростов-на Дону, 202_г.;
- В.Н. Доронькин и др. «ЕГЭ. Химия. Тематический тренинг. Задания высокого уровня сложности» Легион, Ростов-на Дону, 202_г.;
- Д.Ю. Добротина «ЕГЭ. Химия. Типовые экзаменационные варианты», Национальное образование, М, 202_г.;
- Е.В. Зыкова «Сборник задач и упражнений по органической химии» Феникс, Ростов-на Дону, 2019г.;
- Сайт ФИПИ;
- Образовательный портал «РЕШУ ЕГЭ»;
- Сайт «Наука для тебя».
Изучите спецификацию КИМ по предмету
Актуальная информация есть на сайте ФИПИ. Изучайте сначала теорию по каждому вопросу. Помните, что информации из школьного учебника может быть недостаточно. Выполняйте тематические тесты и только потом общие варианты ЕГЭ.
Внимательно читайте задания тестовой части
Не трактуйте тексты задач, основываясь на личных ассоциациях или опыте решения аналогичных заданий. Отвечайте на поставленный вопрос. Например, если вас просят записать ответ с точностью до десятых, не нужно записывать получившееся число полностью. Если просят выписать числа, соответствующие кислоте и щелочи, пишите только в той последовательности, которая соответствует кислоте и щелочи, а не наоборот
Особое внимание нужно обращать и на количество требуемых ответов к заданиям. С 2021 года в заданиях 19 и 20 предлагается выбрать все верные ответы
Их может быть два, три или четыре.
Изучите критерии оценивания заданий части 2
За правильно решенное, но неправильно оформленное задание вы можете потерять баллы. При этом некоторые нюансы знают только эксперты ЕГЭ
Например, необходимо обратить внимание, что если в задании №30 (ОВР) допустимо использовать удвоенные коэффициенты в уравнениях реакций, то в сокращенном ионном уравнении (задание №31) удвоенные коэффициенты недопустимы. Или, если ранее в задании №30 была допустима форма записи:
2Cl+2e=2Cl— 1 восстановление, окислитель;
то сейчас:
2Cl+2e=2Cl— 1 окислитель, восстановление;
т.е. окислитель и восстановитель (можно даже проставить просто буквы О или В) пишутся только спереди (допустимы и другие формы записи).
Если в задании №30 для некоторых химических элементов допустимо поставить и степень окисления, и заряд (S-2 и S2-), то для других элементов этого делать категорически нельзя (N+3, но не N3+, т.к. такой частицы реально не существует).
В задании №33 необходимо обратить внимание, как функциональные заместители или катализаторы влияют на направление химической реакции. Сравните, например, галогенирование алканов на свету и в жестких условиях; гидрогалогенирование несимметричных алкенов при нормальных условиях и в присутствии катализатора H2O2
Не читайте узкоспециализированную литературу
Во-первых, это отнимает время. Во-вторых, помните, что ЕГЭ проверяет школьные знания — они не всегда соответствуют современной науке.
Научитесь работать с непрограммируемым калькулятором
Помните: когда вы считаете в телефоне, он правильно проводит порядок действий. При работе с калькулятором порядок действий вам придется соблюдать самостоятельно. Посчитайте ради интереса в телефоне и на калькуляторе простейший пример: 2+2*2. Сравните ответы.
Проверяйте свои знания
Периодически проверяйте уровень усвоения как новых, так и ранее полученных знаний. Тематические тесты или полные варианты ЕГЭ вы можете найти на сайте ФИПИ. Подготовка к ЕГЭ 2021 по химии будет проще, если под рукой будут все необходимые материалы. Зарегистрируйтесь на нашем сайте и получите доступ к библиотеке полезных материалов для подготовки.
Цепочки (схемы) превращений
Тесты и задания с видео-объяснением:
- На неорганические вещества. Часть 1
- На неорганические вещества. Часть 2
- На органические и неорганические вещества совместно
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Наш канал на YouTube вы можете посмотреть, нажав на эту строку
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония | Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат | Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия | Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH | Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) | Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2022, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 17-19, 22 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 20, 21, 23 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 33, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 34 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
BuboUnicus

- Выпустили 85 стобалльников в 2020 году
- 564 ученика сдали на 90+
- Сотрудничают с экспертом по подготовке к ЕГЭ
- Рассылают полезную теорию подписчикам
- Объясняют сложную химию простым и понятным языком
- Придумывают ассоциации для легкого запоминания
Курс подготовки: СПРИНТ. Химия за 2 месяца
Стандартный пакет включает:
- ~12 видеоуроков в неделю по 30-40 минут
- Учебные скрипты и домашняя работа
- Тайм-коды к видео
- Общий чат для общения
- Расширенное вступительное тестирование
- Открытые линии с менторами
- Пробный онлайн ЕГЭ
- Доступ к Базе знаний BUBO (базовый)
- Курсы с экспертом ЕГЭ
В расширенный тариф СПРИНТ+ входит:
- Личный ментор
- Доступ к базе знаний BUBO (расширенный)
- Спецкурс психолога
- Курс по тайм-менеджменту
Все уроки курса будут доступны до самого ЕГЭ.
Химические реакции (ОВР, химическое равновесие, скорость реакции и т.п.)
Тесты и задания с видео-объяснением:
- Тесты по теме Химические реакции. Часть 1
- Тесты по теме Химические реакции. Часть 2
- Тесты по теме Химические реакции. Часть 3
- Тесты по теме Химические реакции. Часть 4
- Тесты по теме Химические реакции. Часть 5
Тесты и задания без видео-объяснения (с ответами):
- Тест по теме Химические реакции
- Окислительно-восстановительные реакции. Часть 1
- Окислительно-восстановительные реакции. Часть 2
- Окислительно-восстановительные реакции. Часть 3
- Окислительно-восстановительные реакции. Часть 4
- Классификация химических реакций в неорганической и органической химии. Часть 1
- Классификация химических реакций в неорганической и органической химии. Часть 2
- Скорость химической реакции, её зависимость от различных факторов. Часть 1
- Скорость химической реакции, её зависимость от различных факторов. Часть 2
- Реакции окислительно-восстановительные. Окислители и восстановители. Часть 1
- Реакции окислительно-восстановительные. Окислители и восстановители. Часть 2
- Электролиз растворов и расплавов. Часть 1
- Электролиз растворов и расплавов. Часть 2
- Химическое равновесие. Часть 1
- Химическое равновесие. Часть 2
Изменения в ЕГЭ по химии 2022
Задание № 5 в вариантах прошлых лет предполагало установление соответствия между формулами или названиями веществ и классами неорганических соединений. Теперь перед выпускниками появится таблица из девяти ячеек с формулами веществ, среди которых нужно выбрать три согласно условию задания.
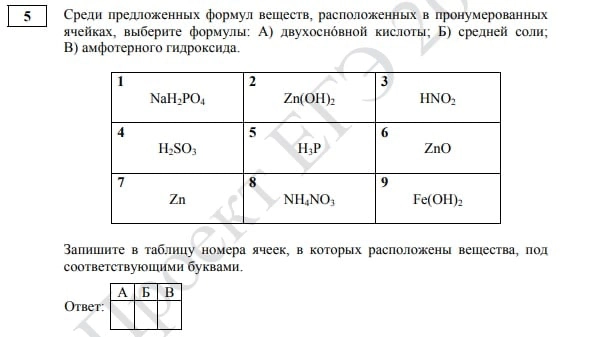
Задание № 5, ЕГЭ по химии 2022
Ребята, которые не разбираются в химических свойствах простых веществ и оксидов, могут ненадолго выдохнуть, ведь задание на эти классы веществ (ранее № 6) исчезло из КИМа 2022 года. Но не спешите радоваться слишком сильно. Эти темы все равно придется освоить, ведь это может встретиться как в первой, так и во второй части ЕГЭ.
В задании на поиск изомеров, гомологов и других особенностей строения органических молекул теперь вместо выбора двух ответов выпускникам предстоит выбрать все правильные ответы. Практика показывает, что чаще верными являются 2, 3 или 4 ответа.
Бывшие задания 13 (свойства и получение углеводородов) и 14 (свойства и получение кислородсодержащих веществ) теперь объединены в одно задание с выбором двух правильных ответов.
Небольшое изменение коснулось задания на электролиз. Одно стало несколько проще. Теперь нужно установить продукты электролиза для трех соединений, а не четырех. Вместе с тем уменьшилась и «стоимость» этого номера: один первичных балл вместо двух.
Задание на гидролиз изменилось кардинально. Выпускникам предстоит не только установить тип среды в растворе предложенных веществ, но и расположить их в определенном порядке изменения рН раствора. Но не спешите паниковать, в КИМе появились подсказки именно для этого номера: вам предлагается шкала изменения рН и типов среды растворов.

Справочные материалы к заданию № 21 на гидролиз, ЕГЭ по химии 2022
И последнее изменение — это появление нового задания на концентрацию № 23. Оно представляет собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. На первый взгляд, это задание требует принципиально новой теории и формул. Но поверьте, немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы.
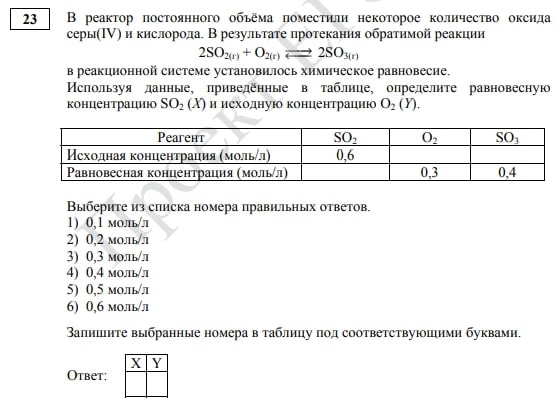
Задание № 23, ЕГЭ по химии 2022
Хотите сдать ЕГЭ на высокие баллы, но не знаете, как приступить к подготовке? Вам поможет учебный центр MAXIMUM! Наши преподаватели знают, как подготовить ученика на 80+ баллов, ведь они сами отлично сдали этот экзамен. Читайте подробнее про наши курсы и выбирайте подходящий!
Какой учебник по химии лучше
На основе сравнения достоинств, недостатков, актуальности информации, наличия гдз команда ВыборЭксперта.ру выбрала 4 издания для подготовки к экзаменам и углубления знаний по химии:
- Для изучения азов подойдёт учебник 8 класса Габриелян.
- Начала органики кратко и интересно описаны в учебнике 9 класса Рудзитис.
- Если нужен профильный учебник химии, рекомендуем материалы Ерёмина за 11 класс.
- Вдогонку к учебнику возьмите углублённый справочник Ерёмина для отработки и повторения теории.
Основываясь на критериях выбора, наших рекомендациях, составьте личный список литературы. Указанных книг достаточно для освоения общей, неорганической и органической химии на профильном уровне.
Организационные моменты
На выполнение заданий даётся три с половиной часа. При хорошей подготовке трёх часов на выполнение всех заданий вполне достаточно. У вас останется ещё 30 минут, чтобы всё перепроверить.
На ЕГЭ разрешается пользоваться калькулятором, в том числе инженерным. Главное, чтобы он не был программируемым. На всякий случай возьмите с собой два калькулятора: инженерный и обычный. Если инженерный калькулятор всё-таки заберут, вам не придётся считать в столбик, теряя время. Начните пользоваться калькулятором ещё при подготовке к экзамену, чтобы привыкнуть к нему и не ошибиться, нажимая на клавиши.
На экзамене можно пользоваться периодической системой Менделеева, таблицей растворимостей солей, кислот и оснований в воде, а также электрохимическим рядом напряжений металлов. Скачайте эти материалы заранее и потренируйтесь ими пользоваться. Таблица Менделеева на экзамене отличается от школьных таблиц, раскрашенных разными цветами
Особое внимание обратите на главную и побочную подгруппы: в таблицах ЕГЭ они не подписаны, а определять их по принципу «справа и слева» — неверно

Периодическая система химических элементов Д.И. Менделеева
Растворимость кислот, солей и оснований в воде и электрохимический ряд напряжений металлов
Заложите не меньше часа для переноса выполненной работы на чистовик. При проверке и оценивании ЕГЭ черновики не учитываются.
Результаты первой части ЕГЭ по химии не пересматриваются. А вот результаты второй части могут быть пересмотрены, если вы подадите апелляцию. По итогам апелляции вам могут добавить баллы. Случаи, когда после апелляции баллы снимают, очень редки, поэтому если вы уверены, что решили верно, смело подавайте заявление. Если сомневаетесь — посоветуйтесь с преподавателем или старшими товарищами, хорошо знающими химию.
Основные понятия и законы химии
Тесты и задания с видео-объяснением:
- Тесты по теме Основные понятия и законы химии. Часть 1
- Тесты по теме Основные понятия и законы химии. Часть 2
- Тесты по теме Основные понятия и законы химии. Часть 3
- Тесты по теме Основные понятия и законы химии. Часть 4
- Тесты по теме Основные понятия и законы химии. Часть 5
- Тесты по теме Основные понятия и законы химии. Часть 6
- Тесты по теме Основные понятия и законы химии. Часть 7
Тесты и задания без видео-объяснения (с ответами):
- Электроотрицательность, степень окисления и валентность химических элементов. Часть 1
- Электроотрицательность, степень окисления и валентность химических элементов. Часть 2
Теория к заданию 11 из ЕГЭ по химии
Классификация органических соединений
Известно, что свойства органических веществ определяются их составом и химическим строением. Поэтому неудивительно, что в основе классификации органических соединений лежит именно теория строения — теория А. М. Бутлерова. Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. Наиболее прочной и малоизменяемой частью молекулы органического вещества является ее скелет — цепь атомов углерода. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цепи (циклы) в молекулах.
Классификация органических веществ (по строению углеродной цепи молекул).
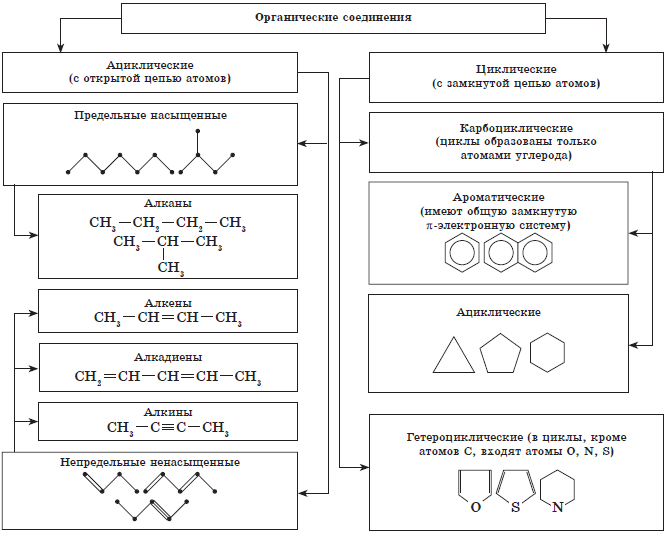
Помимо атомов углерода и водорода молекулы органических веществ могут содержать атомы и других химических элементов. Вещества, в молекулах которых эти так называемые гетероатомы включены в замкнутую цепь, относят к гетероциклическим соединениям.
Гетероатомы (кислород, азот и др.) могут входить в состав молекул и ациклических соединений, образуя в них функциональные группы, например, гидроксильную — $ОН$, карбонильную , карбоксильную — , аминогруппу — $NH_2$.
Номенклатура органических соединений
В начале развития органической химии открываемым соединениям присваивались тривиальные названия, часто связанные с историей их получения: уксусная кислота (являющаяся основой винного уксуса), масляная кислота (образующаяся в сливочном масле), гликоль (т.е. сладкий) и т.д. По мере увеличения числа новых открытых веществ возникла необходимость связывать названия с их строением. Так появились рациональные названия: метил амин, диэтиламин, этиловый спирт, метилэтилкетон, в основе которых лежит название простейшего соединения. Для более сложных соединений рациональная номенклатура непригодна.
Теория строения А. М. Бутлерова стала основой для классификации и номенклатуры органических соединений по структурным элементам и по расположению атомов углерода в молекуле. В настоящее время наиболее употребляемой является номенклатура, разработанная Международным союзом теоретической и прикладной химии (IUРАС), которая называется номенклатурой ИЮПАК. Правила ИЮПАК рекомендуют для образования названий несколько принципов, один из них — принцип замещения. На основе этого разработана заместительная номенклатура, которая является наиболее универсальной. Приведем несколько основных правил заместительной номенклатуры и рассмотрим их применение на примере гетерофункционального соединения, содержащего две функциональные группы, — аминокислоты лейцина:
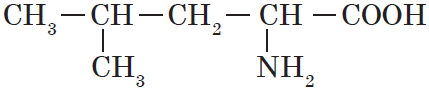
1. В основе названия соединений лежит родоначальная структура (главная цепь ациклической молекулы, карбоциклическая или гетероциклическая система). Название родоначальной структуры составляет основу названия, корень слова.
В данном случае родоначальной структурой является цепь из пяти атомов углерода, связанных одинарными связями. Таким образом, коренная часть названия — пентан.
2. Характеристические группы и заместители (структурные элементы) обозначаются префиксами и суффиксами. Характеристические группы подразделяются по старшинству. Порядок старшинства основных групп:
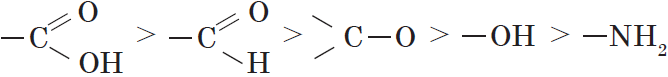
Выявляют старшую характеристическую группу, которую обозначают в суффиксе. Все остальные заместители называют в префиксе в алфавитном порядке.
В данном случае старшей характеристической группой является карбоксильная, т.е. это соединение относится к классу карбоновых кислот, поэтому к коренной части названия добавляем -овая кислота. Второй по старшинству группой является аминогруппа, которая обозначается префиксом амино-. Кроме этого, молекула содержит углеводородный заместитель метил-. Таким образом, основой названия является аминометилпентановая кислота.
3. В название включают обозначение двойной и тройной связи, которое идет сразу после корня. Рассматриваемое соединение не содержит кратных связей.
4. Атомы родоначальной структуры нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе расположена старшая характеристическая группа:
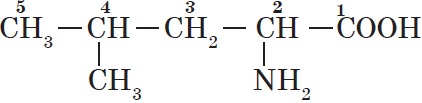
Нумерацию цепи начинают с атома углерода, входящего в состав карбоксильной группы, ему присваивается номер $1$. В этом случае аминогруппа окажется при углероде $2$, а метил — при углероде $4$.
Таким образом, природная аминокислота лейцин по правилам номенклатуры ИЮПАК называется $2$-амино-$4$-метилпентановая кислота.
Строение атома и периодический закон
Тесты и задания с видео-объяснением:
- Тесты по теме Строение атома и периодический закон. Часть 1
- Тесты по теме Строение атома и периодический закон. Часть 2
- Тесты по теме Строение атома и периодический закон. Часть 3
- Тесты по теме Строение атома и периодический закон. Часть 4
- Тесты по теме Строение атома и периодический закон. Часть 5
- Тесты по теме Строение атома и периодический закон. Часть 6
Тесты и задания без видео-объяснения (с ответами):
- Электронная конфигурация атома. Часть 1
- Электронная конфигурация атома. Часть 2
- Закономерности изменения химических свойств элементов. Характеристика элементов. Часть 1
- Закономерности изменения химических свойств элементов. Характеристика элементов. Часть 2
Ответы:
Вторая часть:
- Br2 + SO2 + 2H2O = 2HBr + H2SO4
S+4 – 2e = S+6 1
Br2 + 2e = 2Br-1 1
Сера в степени окисления +4 (или SO2) является восстановителем.
Бром в степени окисления 0 (или Br2) является окислителем.
- Al(NO3)3 + 3KHCO3 = Al(OH)3↓ + 3CO2↑ + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
- 1) Na2S + 8NaNO2 + 4H2SO4 = 8NO + 5Na2SO4 +4H2O
или 2NaNO2 + Na2S + 2H2SO4 = 2Na2SO4 + S + 2NO + 2H2O
2) 2NO + O2 = 2NO2
3) 4NO2 + O2 + 2H2O = 4HNO3
4) Cu2S + 12HNO3 → CuSO4 + Cu(NO3)2 + 6H2O + 10NO2
- W(BaCl2) = 20%, W(Ba(OH)2) = 6,6%
Решение: смотри видео
- 1) n (CO2) = m (CO2) / M (CO2) = 5,5 г / 44 г/моль = 0,125 моль
n (C) = n (CO2) = 0,125 моль.
n (HCl) = V (HCl) / Vm = 3,36 л / 22,4 л/моль = 0,15 моль, тогда:
n (H) = n (HCl) = 0,15 моль
n (Cl) = n (HCl) = 0,15 моль.
m (C) = n (C) ∙ M (C) = 0,125 моль ∙ 12 г/моль = 1,5 г
m (Н) = n (Н) ∙ M (Н) = 0,15 моль ∙ 1 г/моль = 0,15 г
m (Cl) = n (Cl) ∙ M (Cl) = 0,15 моль ∙ 35,5 г/моль = 5,325 г
m (O) = m (в-ва) – m (C) – m (H) – m (Cl) = 6,975 г – 1,5 г – 0,15 г – 5,325 г = 0, следовательно кислорода нет в составе вещества А.
Представим формулу вещества А в виде CxHyClz, тогда
x : y : z = 0,125 : 0,15 : 0,15 = 1 : 1,2 : 1,2 = 5 : 6 : 6
Таким образом, молекулярная формула вещества А – C5H6Cl6.
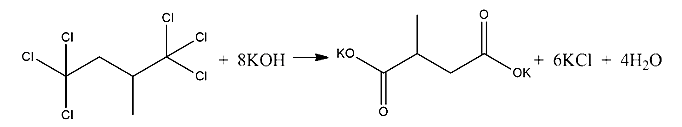
2) При этом нам известно, что при гидролизе вещества А образуется соль Б, не содержащая атомов хлора, значит в структуре вещества А атомы хлора находятся в концевых положениях (в противном случае при гидролизе атомы хлора бы не взаимодействовали с водой). Другими словами, надо было подумать, в каком случае галогеналканы переходят в карбоновые кислоты или соли этих карбоновых кислот — когда у одного атома углерода сразу три атома хлора, тогда атомы хлора замепщаются на гидроксильные группы, но у одного атома углерода не может быть две и более гидроксильных шрупп, поэтому происходит трансформация в карбоксильную группу, которая затем также реагирует со щёлочью и даёт соль. Дополнительно известно, что в молекуле органического соединения А имеется третичный атом (значит от него отходит по отдельности 3 атома углерода). Отсюда строим структурную формулу вещества А:
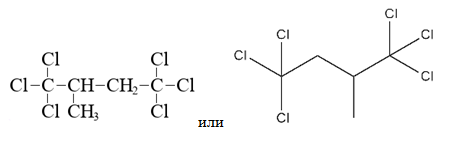
3) 
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Просмотреть все тесты по органической химии
- Просмотреть все тесты по неорганической химии
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
SkySmart

Сайт: https://skysmart.ru/Стоимость: от 990 р. за индивидуальный урок, первый пробный урок — бесплатно
Индивидуальные уроки химии для 9–11 классовПодготовят к ОГЭ и ЕГЭ, помогут поступить в профильный вуз
Онлайн-платформа, где можно учиться когда и откуда угодно:
- Видеосвязь
- Интерактивные задания
- Виртуальная доска
Раз в месяц учитель рассказывает родителям, как проходили занятия.
Все достижения ученика видны в личном кабинете пользователя.
В основе урока — видео с опытами. Некоторые можно повторить дома.
Доступные варианты занятий:
- 4 урока — Разобрать трудную тему, попробовать готовиться к ЕГЭ и ОГЭ онлайн
- 8 уроков — Проработать 2–3 темы или разобрать задания первого пробника
- 16 уроков — Закрепить и углубить знания перед контрольной, уроком или экзаменом
- Годовой курс — Заниматься по одному или нескольким предметам и пройти программу всего класса. Уметь писать любое уравнение реакции и решать все задачи из учебника